更新于2019-05-28 ·閱讀:422
一、行業屬性
(一)、普通行業
營業執照
1、依法辦理市場主體登記,辦理營業執照。
《無證無照經營查處辦法》第七條 經營者未依法取得營業執照從事經營活動的, 由履行工商行政管理職責的部門予以查處。
《電子商務法》第十條 電子商務經營者應當依法辦理市場主體登記
《網絡交易管理辦法》第七條 從事網絡商品交易及有關服務的經營者,應當依法辦理工商登記。 從事網絡商品交易的自然人,應當通過第三方交易平臺開展經營活動, 并向第三方 交易平臺提交其姓名、地址、有效身份證明、有效聯系方式等真實身份信 息。具備登記注冊條件的,依法辦理工商登記。
第二十二條 第三方交易平臺經營者應當是經工商行政管理部門登記注冊并領取 營業執照的企業法人。
2、電子商務經營者亮照經營業務,即持續公示營業執照信息。
《電子商務法》第十五條 電子商務經營者應當在其首頁顯著位置,持續公示營業 執照信息……或者上述信息的鏈接標識。前款規定的信息發生變更的,電子商務經營者 應當及時更新公示信息。
《網絡交易管理辦法》第八條 已經工商行政管理部門登記注冊并領取營業執照的法人、其他經濟組織或者個體工商戶,從事網絡商品交易及有關服務的,應當在其網站首頁或者從事經營活動 的主頁面醒目位置公開營業執照登載的信息或者其營業執照的電子鏈接標識。 第三十一條 第三方交易平臺經營者擬終止提供第三方交易平臺服務的,應當至少提前三個月在其網站主頁面醒目位置予以公示并通知相關經營者和消費者,采取必要措施保障相關經營者和消費者的合法權益。
自建購物網站類:“優衣庫”購物網站
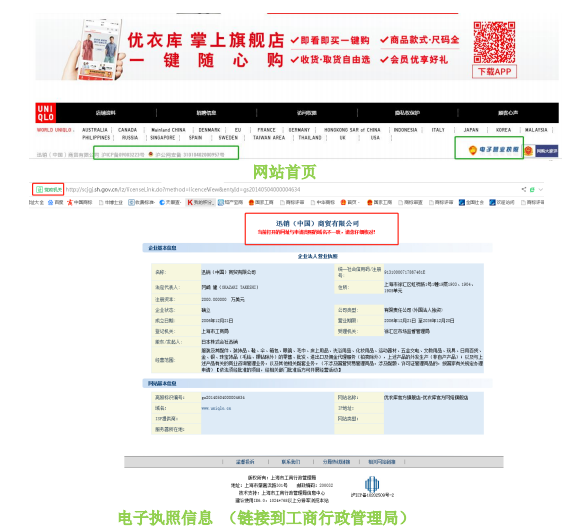
電子商務平臺(第三方平臺):京東


天貓商城
(二)特殊領域(列舉部分):食品、醫療保健、藥品和醫療器械、新聞、出版、教育……
《無證無照經營查處辦法》第七條 經營者未依法取得行政許可且未取得營業執照從事經營活動的,依照本辦法第五條的規定查處。
《電子商務法》第四條 國家平等對待線上線下商務活動,促進線上線下融合發展,各級人民政府 和有關部門不得采取歧視性的政策措施,不得濫用行政權力排除、限制市場競爭。“平等對待”的理解:對于線下從事特定的經營活動,如果需要獲得許可的,相應的要求應當自動地延伸到線上經營活動。
第十五條:電子商務經營者應當在其首頁顯著位置,持續公示……與其經營業務有 關的行政許可信息……或者上述信息的鏈接標識。 前款規定的信息發生變更的,電子 商務經營者應當及時更新公示信息。
《互聯網信息服務管理辦法》第五條 從事新聞、出版、教育、醫療保健、藥品和醫療器械等互聯網信息服務, 依照法律、行政法規以及國家有關規定須經有關主管部門審核同意的,在申請經營許可 或者履行備案手續前,應當依法經有關主管部門審核同意。
《網絡交易管理辦法》第七條 從事網絡商品交易及有關服務的經營者銷售的商品或者提供的服務屬 于法律、行政法規或者國務院決定規定應當取得行政許可的,應當依法取得有關許可。
1、食品領域: 《食品安全法》、《食品安全實施條例》、《食品生產許可管理辦法》 、《食品經營許可管理辦法》、《網絡餐飲服務食品安全監督管理辦法》、《網絡食品安全違法行為查處辦法》、《特殊醫學用途配方食品注冊管理辦法》、《保健食品注冊與備案管理辦法》、《嬰幼兒配方乳粉產品配方注冊管理辦法》
(1)普通食品:食品經營許可證、食品生產許可證
《食品安全法》 第二條 在中華人民共和國境內從事下列活動,應當遵守本法: 食品生產和加工(以下稱食品生產),食品銷售和餐飲服務(以下稱食品經營); 食品添加劑的生產經營;用于食品的包裝材料、容器、洗滌劑、消毒劑和用于食品生產 經營的工具、設備(以下稱食品相關產品)的生產經營;食品生產經營者使用食品添加 劑、食品相關產品;食品的貯存和運輸;對食品、食品添加劑、食品相關產品的安全管 理。 第三十五條 國家對食品生產經營實行許可制度。從事食品生產、食品銷售、餐飲 服務,應當依法取得許可。但是,銷售食用農產品,不需要取得許可。 第三十九條 國家對食品添加劑生產實行許可制度……并依照本法第三十五條第 二款規定的程序,取得食品添加劑生產許可。
《食品安全實施條例》 第二十條 食品生產經營者應當依法取得相應的食品生產經營許可。法律、法規對食品生產加 工小作坊和食品攤販另有規定的,依照其規定。 食品生產經營許可的有效期為 3 年。
《網絡餐飲服務食品安全監督管理辦法》 第四條 入網餐飲服務提供者應當具有實體經營門店并依法取得食品經營許可證,并按照食品經營許可證載明的主體業態、經營項目從事經營活動,不得超范圍經營。
《網絡交易管理辦法》 第十一條 網絡商品經營者向消費者銷售商品或者提供服務,應當向消費者提供經營地址、聯系方式、商品或者服務的數量和質量、價款或者費用、履行期限和方式、支 付形式、退換貨方式、安全注意事項和風險警示、售后服務、民事責任等信息,采取安 全保障措施確保交易安全可靠,并按照承諾提供商品或者服務。
《網絡食品安全違法行為查處辦法》 第八條 網絡食品交易第三方平臺提供者應當在通信主管部門批準后 30 個工作日內,向所在地省級食品藥品監督管理部門備案,取得備案號。通過自建網站交易的食品 生產經營者應當在通信主管部門批準后 30 個工作日內,向所在地市、縣級食品藥品監 督管理部門備案,取得備案號。
第十八條 通過第三方平臺進行交易的食品生產經營者應當在其經營活動主頁面 顯著位置公示其食品生產經營許可證。通過自建網站交易的食品生產經營者應當在其網 站首頁顯著位置公示營業執照、食品生產經營許可證。 餐飲服務提供者還應當同時公 示其餐飲服務食品安全監督量化分級管理信息。相關信息應當畫面清晰,容易辨識。 《食品生產許可管理辦法》 第四條 食品生產許可實行一企一證原則,即同一個食品生產者從事食品生產活動, 應當取得一個食品生產許可證。
第十條 申請食品生產許可,應當先行取得營業執照等合法主體資格。 企業法人、 合伙企業、個人獨資企業、個體工商戶等,以營業執照載明的主體作為申請人。
第十一條 申請食品生產許可,應當按照以下食品類別提出:糧食加工品,食用油、 油脂及其制品,調味品,肉制品,乳制品,飲料,方便食品,餅干,罐頭,冷凍飲品, 速凍食品,薯類和膨化食品,糖果制品,茶葉及相關制品,酒類,蔬菜制品,水果制品, 炒貨食品及堅果制品,蛋制品,可可及焙烤咖啡產品,食糖,水產制品,淀粉及淀粉制品,糕點,豆制品,蜂產品,保健食品,特殊醫學用途配方食品,嬰幼兒配方食品,特 殊膳食食品,其他食品等。 國家食品藥品監督管理總局可以根據監督管理工作需要對 食品類別進行調整。
第二十三條 食品添加劑生產許可申請符合條件的,由申請人所在地縣級以上地方食 品藥品監督管理部門依法頒發食品生產許可證,并標注食品添加劑。
第二十九條 食品生產許可證編號由 SC(“生產”的漢語拼音字母縮寫)和 14 位阿拉伯數字組成。 數字從左至右依次為:3 位食品類別編碼、2 位省(自治區、直轄市)代碼、2 位市(地) 代碼、2 位縣(區)代碼、4 位順序碼、1 位校驗碼。 關聯文件:(總局關于貫徹實施《食品生產許可管理辦法》有關問題的通知--食藥 監食監一〔2017〕53 號)
第九條 關于“QS”及“XK”編號證書更換“SC”編號證書有關問題。食品生產者 在 2015 年 10 月 1 日后取得食品生產許可,證書編號仍為“QS”及“XK”編號證書的, 各地食品藥品監管部門應督促企業在 2018 年 10 月 1 日前將所持證書更換為“SC”編號 證書。2018 年 10 月 1 日起,食品生產者生產的食品不得再使用原包裝、標簽和“QS”標志。
《食品經營許可管理辦法》 第十條 申請食品經營許可,應當按照食品經營主體業態和經營項目分類提出。 食品經營主體業態分為食品銷售經營者、餐飲服務經營者、單位食堂。食品經營者 申請通過網絡經營、建立中央廚房或者從事集體用餐配送的,應當在主體業態后以括號 標注。 食品經營項目分為預包裝食品銷售(含冷藏冷凍食品、不含冷藏冷凍食品)、散裝 食品銷售(含冷藏冷凍食品、不含冷藏冷凍食品)、特殊食品銷售(保健食品、特殊醫 學用途配方食品、嬰幼兒配方乳粉、其他嬰幼兒配方食品)、其他類食品銷售;熱食類 食品制售、冷食類食品制售、生食類食品制售、糕點類食品制售、自制飲品制售、其他 類食品制售等……
“餓了么”平臺入駐商家
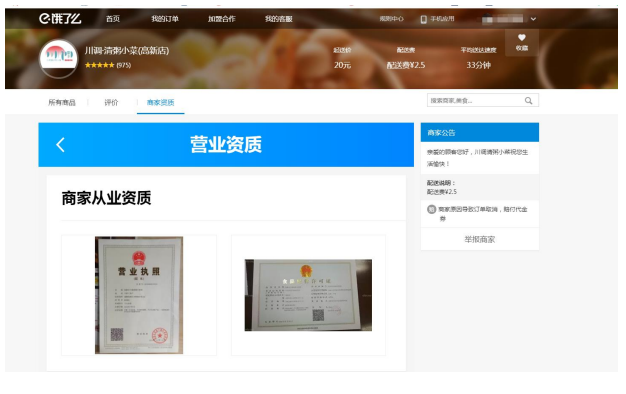
電子商務平臺(第三方平臺):美團

(2)特殊食品:保健食品、特殊醫學用途配方食品、嬰幼兒配方乳粉等)
《食品安全法》 第七十四條 國家對保健食品、特殊醫學用途配方食品和嬰幼兒配方食品等特殊食品 實行嚴格監督管理。
第七十六條 使用保健食品原料目錄以外原料的保健食品和首次進口的保健食品應當 經國務院食品安全監督管理部門注冊。但是,首次進口的保健食品中屬于補充維生素、 礦物質等營養物質的,應當報國務院食品安全監督管理部門備案。其他保健食品應當報 省、自治區、直轄市人民政府食品安全監督管理部門備案。
第七十八條 保健食品的標簽、說明書不得涉及疾病預防、治療功能,內容應當真實,與注冊或者備案的內容相一致,載明適宜人群、不適宜人群、功效成分或者標志性 成分及其含量等,并聲明“本品不能代替藥物”。保健食品的功能和成分應當與標簽、 說明書相一致。
第八十條 特殊醫學用途配方食品應當經國務院食品安全監督管理部門注冊。注冊 時,應當提交產品配方、生產工藝、標簽、說明書以及表明產品安全性、營養充足性和 特殊醫學用途臨床效果的材料。

源自:《特殊醫學用途配方食品注冊審批事項服務指南》
第八十一條…… 嬰幼兒配方食品生產企業應當將食品原料、食品添加劑、產品配 方及標簽等事項向省、自治區、直轄市人民政府食品安全監督管理部門備案。 嬰幼兒配方乳粉的產品配方應當經國務院食品安全監督管理部門注冊。注冊時,應當提交配方研發報告和其他表明配方科學性、安全性的材料。 不得以分裝方式生產嬰幼兒配方乳粉,同一企業不得用同一配方生產不同品牌的嬰 幼兒配方乳粉。
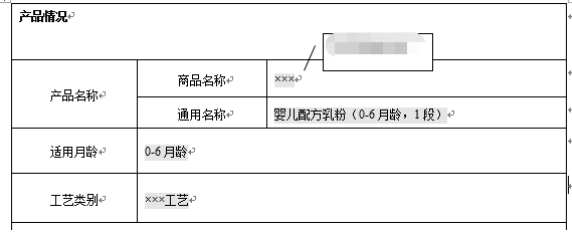
源自:《嬰幼兒配方乳粉產品配方注冊審批事項服務指南》
《食品經營許可管理辦法》 食品經營項目分為預包裝食品銷售(含冷藏冷凍食品、不含冷藏冷凍食品)、散裝 食品銷售(含冷藏冷凍食品、不含冷藏冷凍食品)、特殊食品銷售(保健食品、特殊醫 學用途配方食品、嬰幼兒配方乳粉、其他嬰幼兒配方食品)、其他類食品銷售;熱食類 食品制售、冷食類食品制售、生食類食品制售、糕點類食品制售、自制飲品制售、其他 類食品制售等……
《保健食品注冊與備案管理辦法》 第九條 生產和進口下列產品應當申請保健食品注冊: (一)使用保健食品原料目錄以外原料(以下簡稱目錄外原料)的保健食品; (二)首次進口的保健食品(屬于補充維生素、礦物質等營養物質的保健食品除外)。 首次進口的保健食品,是指非同一國家、同一企業、同一配方申請中國境內上市銷售的保健食品。
第十一條 國產保健食品注冊申請人應當是在中國境內登記的法人或者其他組織; 進口保健食品注冊申請人應當是上市保健食品的境外生產廠商。 申請進口保健食品注冊的,應當由其常駐中國代表機構或者由其委托中國境內的代 理機構辦理。 境外生產廠商,是指產品符合所在國(地區)上市要求的法人或者其他組織。
《網絡食品違法行為查處辦法》 第十九條 入網銷售保健食品、特殊醫學用途配方食品、嬰幼兒配方乳粉的食品生產經營者,除依照本辦法第十八條的規定公示相關信息外,還應當依法公示產品注冊證書或者備案憑證,持有廣告審查批準文號的還應當公示廣告審查批準文號,并鏈接至食品藥品監督管理部門網站對應的數據查詢頁面。保健食品還應當顯著標明“本品不能代替藥物”。 特殊醫學用途配方食品中特定全營養配方食品不得進行網絡交易。
嬰幼兒配方奶粉
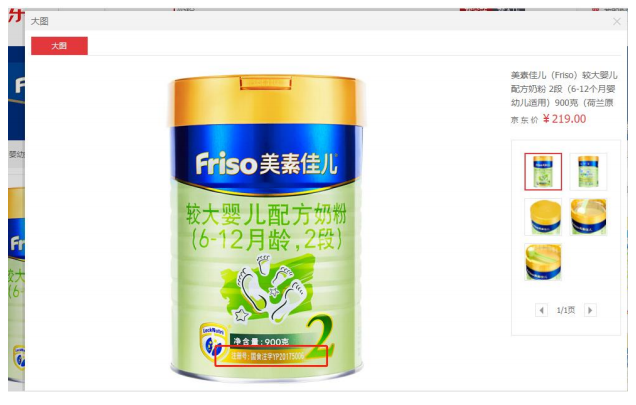
保健品:湯臣倍健蛋白粉


特殊醫學用途配方食品:雀巢特別能恩早產兒嬰兒配方奶粉


2、醫療器械領域
許可證類型 《醫療器械生產許可證》、《醫療器械經營許可證》、《互聯網藥品信息服務資格證書》 相關規定: 《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械經營監督管理辦 法》、《醫療器械生產監督管理辦法》、《醫療器械分類規則》、《醫療器械網絡銷售監督管理辦法》、《互聯網藥品信息管理辦法》
《醫療器械監督管理條例》 第四條 國家對醫療器械按照風險程度實行分類管理。 第一類是風險程度低,實行常規管理可以保證其安全、有效的醫療器械。 第二類是具有中度風險,需要嚴格控制管理以保證其安全、有效的醫療器械。 第三類是具有較高風險,需要采取特別措施嚴格控制管理以保證其安全、有效的醫療器械。
第八條 第一類醫療器械實行產品備案管理,第二類、第三類醫療器械實行產品注 冊管理。 《醫療器械注冊管理辦法》 第五條 第一類醫療器械實行備案管理。第二類、第三類醫療器械實行注冊管理 境內第一類醫療器械備案,備案人向設區的市級食品藥品監督管理部門提交備案資料。 境內第二類醫療器械由省、自治區、直轄市食品藥品監督管理部門審查,批準后發 給醫療器械注冊證。 境內第三類醫療器械由國家食品藥品監督管理總局審查,批準后發給醫療器械注冊證。 進口第一類醫療器械備案,備案人向國家食品藥品監督管理總局提交備案資料。 進口第二類、第三類醫療器械由國家食品藥品監督管理總局審查,批準后發給醫療器械注冊證。 香港、澳門、臺灣地區醫療器械的注冊、備案,參照進口醫療器械辦理。 《醫療器械分類規則》 第六條 醫療器械的分類應當根據醫療器械分類判定表(見附件)進行分類判定… 《醫療器械生產監督管理辦法》 第八條 開辦第二類、第三類醫療器械生產企業的,應當向所在地省、自治區、直轄市食品藥品監督管理部門申請生產許可,并提交以下資料…… 第十一條 開辦第一類醫療器械生產企業的,應當向所在地設區的市級食品藥品監 督管理部門辦理第一類醫療器械生產備案,提交備案企業持有的所生產醫療器械的備案 憑證復印件和本辦法第八條規定的資料(第二項除外)。 《醫療器械經營監督管理辦法》 第四條 按照醫療器械風險程度,醫療器械經營實施分類管理。 經營第一類醫療器械不需許可和備案,經營第二類醫療器械實行備案管理,經營第三類醫療器械實行許可管理。
第八條 從事第三類醫療器械經營的,經營企業應當向所在地設區的市級食品藥品監督管理 部門提出申請,并提交以下資料…..
第十二條 從事第二類醫療器械經營的,經營企業應當向所在地設區的市級食品藥品監督管理 部門備案,填寫第二類醫療器械經營備案表,并提交本辦法第八條規定的資料(第八項除外)。 《醫療器械網絡銷售監督管理辦法》 第七條 從事醫療器械網絡銷售的企業應當是依法取得醫療器械生產許可、經營許可或者辦理備案的醫療器械生產經營企業。法律法規規定不需要辦理許可或者備案的除外。
第八條 從事醫療器械網絡銷售的企業,應當填寫醫療器械網絡銷售信息表,將企業名稱、法定代表人或者主要負責人、網站名稱、網絡客戶端應用程序名、網站域名、 網站 IP 地址、電信業務經營許可證或者非經營性互聯網信息服務備案編號、醫療器械 生產經營許可證件或者備案憑證編號等信息事先向所在地設區的市級食品藥品監督管理部門備案。相關信息發生變化的,應當及時變更備案。
第九條 從事醫療器械網絡銷售的企業,應當通過自建網站或者醫療器械網絡交易服務第三方平臺開展醫療器械網絡銷售活動。 通過自建網站開展醫療器械網絡銷售的企業,應當依法取得《互聯網藥品信息服務資格證書》,并具備與其規模相適應的辦公場所以及數據備份、故障恢復等技術條件。
第十條 從事醫療器械網絡銷售的企業,應當在其主頁面顯著位置展示其醫療器械生產經營許可證件或者備案憑證,產品頁面應當展示該產品的醫療器械注冊證或者備案憑證。相關展示信息應當畫面清晰,容易辨識。其中,醫療器械生產經營許可證件或者備案憑證、醫療器械注冊證或者備案憑證的編號還應當以文本形式展示。相關信息發生變更的,應當及時更新展示內容。
第十五條 醫療器械網絡交易服務第三方平臺提供者應當依法取得《互聯網藥品信息服務資格證書》,具備與其規模相適應的辦公場所以及數據備份、故障恢復等技術條件,設置專門的醫療器械網絡質量安全管理機構或者配備醫療器械質量安全管理人員。
第十六條 醫療器械網絡交易服務第三方平臺提供者應當向所在地省級食品藥品監 督管理部門備案,填寫醫療器械網絡交易服務第三方平臺備案表,并提交以下材料…… 《互聯網藥品信息管理辦法》 第五條 擬提供互聯網藥品信息服務的網站,應當在向國務院信息產業主管部門或 者省級電信管理機構申請辦理經營許可證或者辦理備案手續之前,按照屬地監督管理的 原則,向該網站主辦單位所在地省、自治區、直轄市食品藥品監督管理部門提出申請, 經審核同意后取得提供互聯網藥品信息服務的資格。 第六條 各省、自治區、直轄市食品藥品監督管理部門對本轄區內申請提供互聯網 藥品信息服務的互聯網站進行審核,符合條件的核發《互聯網藥品信息服務資格證書》。 第十三條 申請提供互聯網藥品信息服務,應當填寫國家食品藥品監督管理總局統 一制發的《互聯網藥品信息服務申請表》,向網站主辦單位所在地省、自治區、直轄市 食品藥品監督管理部門提出申請,同時提交以下材料: (一)企業營業執照復印件。 (二)網站域名注冊的相關證書或者證明文件。從事互聯網藥品信息服務網站的中 文名稱,除與主辦單位名稱相同的以外,不得以“中國”“中華”“全國”等冠名;除取 得藥品招標代理機構資格證書的單位開辦的互聯網站外,其他提供互聯網藥品信息服務 的網站名稱中不得出現“電子商務”“藥品招商”“藥品招標”等內容。
第三方平臺(美團)

天貓入駐商家資質展示



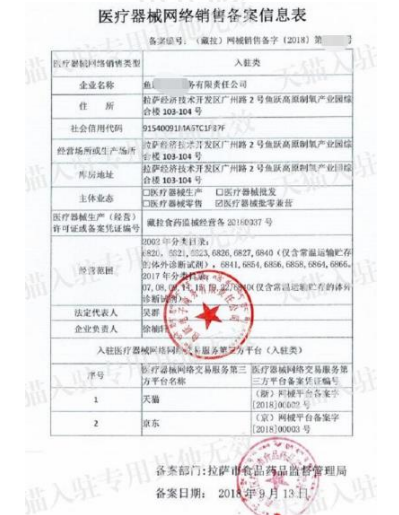
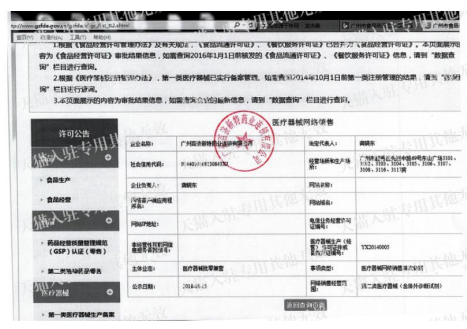
醫療器械產品注冊信息展示
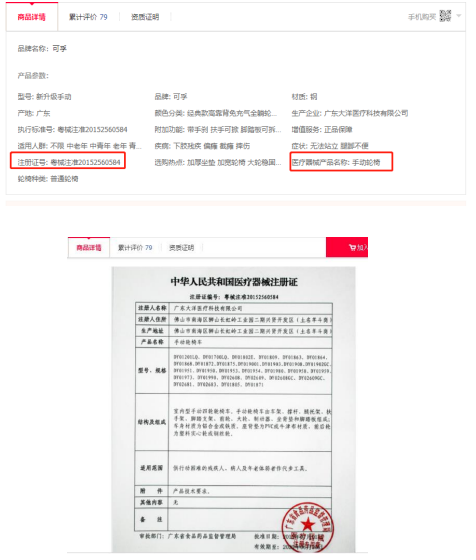
3、藥品生產及銷售領域 許可證類型 《藥品生產許可證》、《醫療器械經營許可證》、《互聯網藥品信息服務資格證書》 相關規定:《藥品管理法》、《藥品管理法實施條例》、《互聯網藥品信息服務管理辦 法》、《中醫藥法》、《藥品經營許可證管理辦法》、《藥品生產監督管理辦法》 《藥品管理法》
第七條 開辦藥品生產企業,須經企業所在地省、自治區、直轄市人民政府藥品監 督管理部門批準并發給《藥品生產許可證》。無《藥品生產許可證》的,不得生產藥品。 《藥品生產許可證》應當標明有效期和生產范圍,到期重新審查發證…… 第十四條 開辦藥品批發企業,須經企業所在地省、自治區、直轄市人民政府藥 品監督管理部門批準并發給《藥品經營許可證》;開辦藥品零售企業,須經企業所在地 縣級以上地方藥品監督管理部門批準并發給《藥品經營許可證》。無《藥品經營許可證》 的,不得經營藥品。 《藥品經營許可證》應當標明有效期和經營范圍,到期重新審查發證。
第十九條 ……藥品經營企業銷售中藥材,必須標明產地。
第二十一條 城鄉集市貿易市場可以出售中藥材,國務院另有規定的除外。
第二十三條 醫療機構配制制劑,須經所在地省、自治區、直轄市人民政府衛生 行政部門審核同意,由省、自治區、直轄市人民政府藥品監督管理部門批準。